国家集采第十批“拟中标”数据和最终顺位
此次集采有62种药品采购成功,均为已过专利期、有多家企业生产、竞争充分的药品,覆盖高血压、糖尿病、肿瘤、心脑血管疾病、感染、精神疾病等领域;共234家企业的385个产品获得拟中选资格。...
《中药复方制剂新药研发人用经验信息收集整理技术指导原则(征求意见稿)》
10月24日,国家药监局药审中心公开征求《中药复方制剂新药研发人用经验信息收集整理技术指导原则(征求意见稿)》意见。图片来源:CDE官网本指导原则的起草目的如下:“三结合”中药注册审评证据体系下,在中医药理论指导下形成的临床经验方或医疗机构制剂,遣方用药的合理性,提供了中医药理论支持其有效性的证据;在临床实践过程中通过积累人用经验,逐步探...
吲哚布芬片被暂停国采资格
9月29日,据上海阳光医药采购网消息,根据杭州市知识产权局《专利侵权纠纷案件行政裁决书》,上海市医药集中招标采购事务管理所已暂停浙江美迪深生物医药有限公司生产的吲哚布芬片采购资格。在该事件得到妥善解决且相关部门解除限制之前,浙江美迪深生物医药有限公司的吲哚布芬片不具备正常的采购资格。除了浙江美迪深生物医药有限公司的吲哚布芬片外,还有以下因...
35个中成药开始集采,上百家药企面临洗牌
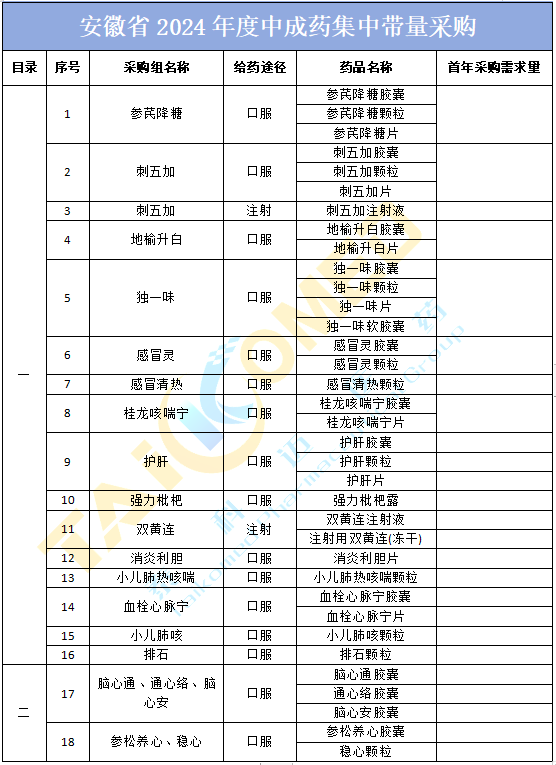
9月9日,安徽省医药联合采购办公室发布《安徽省2024年度中成药集中带量采购文件(征求意见稿)》(以下简称《征求意见稿》),此次集采包含18个产品组、35个中成药,包括感冒灵胶囊、感冒灵颗粒、感冒清热颗粒等OTC品种。...
FDA咨询委员会否决奥贝胆酸
9月3日,欧盟接受CHMP的建议,正式撤销了奥贝胆酸(OCA)的上市许可。鉴于此,FDA特别召集了专家委员会(Gastrointestinal Drugs Advisory Committee,GIDAC)在9月13日对奥贝胆酸申请完全批准进行讨论。在讨论最后的投票环节中,委员会成员以13-1压倒性否认奥贝胆酸的临床获益,唯一投出赞成票来...
CDE《以患者为中心的罕见疾病药物研发试点工作计划(“关爱计划”)》
为指导和帮助研发单位在罕见疾病药物研发全程充分倾听患者声音,推动以患者为中心的罕见疾病药物研发和上市,药审中心组织制定了《以患者为中心的罕见疾病药物研发试点工作计划(“关爱计划”)》(见附件)。经国家药品监督管理局审核同意,现予发布,自发布之日起施行。附件:以患者为中心的罕见疾病药物研发试点工作计划(“关爱计划”)以患者为中心的罕见疾病药...
2024年8月首家通过一致性评价产品汇总
2024年8月份,一共有11个产品通过/视同通过一致性评价。目录如下:药品名称规格企业首家过评ATC分类中文集采注射用盐酸地尔硫卓10mg浙江亚太药业股份有限公司通过心血管系统否盐酸班布特罗片10mg齐鲁制药集团有限公司通过呼吸系统否莫达非尼胶囊100mg湘北威尔曼制药股份有限公司通过神经系统是秋水仙碱片含秋水仙碱0.5mg昆药集团股份有...
8月CDE药审报告:受理1159个品种,完成审批851个
8月CDE共受理新的药品注册申请以品种(按药品+企业维度)统计1159个(受理号1558个),其中化药745个品种,中药251个品种,生物制品163个品种。以审评任务类型统计,受理新药临床试验申请(以下简称IND)152个品种;新药上市许可申请(以下简称NDA)33个品种;同名同方药、仿制药、生物类似药上市许可申请(以下简称ANDA)33...
20年来首个无成瘾风险止痛药VX-548递交上市申请,急性疼痛治疗迎来新突破
美国医药公司Vertex Pharmaceuticals(福泰制药,VRTX.US)开发的新型止痛药VX-548,能够显著降低急性疼痛的等级,约一半左右,且具有无成瘾性的特点。2024年7月30日,Vertex宣布,美国食品药品监督管理局(FDA)已受理该药物的新药上市申请,并给予优先审评资格。VX-548用于治疗中度至重度急性疼痛,如若...
传奇生物「卡卫荻®」在中国获批上市
2024年8月27日,传奇生物(NASDAQ:LEGN)在中国南京正式宣布,公司自主研发的细胞治疗产品卡卫荻®(通用名:西达基奥仑赛注射液)获得国家药品监督管理局(NMPA)批准上市,用于治疗复发或难治性多发性骨髓瘤成人患者,既往接受过至少三线治疗后进展(至少使用过一种蛋白酶体抑制剂及免疫调节剂)。卡卫荻®于2020年8月成为首个被国家药...