脂肪乳专题(二)
从1988年第一个脂质体药物在美国进人临床试验, 到目前已有多种脂质体药物工业 化生产并上市销售, 如脂质体阿霉素、脂质体柔红霉素、脂质体两性霉素、脂质体甲肝疫苗和脂质体乙肝疫苗等。经过近四十年的不断努力, 脂质体递药技术也从最初的普通脂质体, 发展为长效脂质体、靶向脂质体和智能脂质体。所涉及的药物也从常规化学合成药, 延伸到蛋白药、基因药、疫苗和中药。 据统计(The li-posome Company)、SEQUEES公司,INEX制药公司、NORTERNLIPIDS公司、CELATOR科技公司等十多家公司专门从事脂质体药物制剂的研究。世界制药十强企业都以控股、自研及合作等多种形式介入了脂质体药物开发领域, 从这也不难看出脂质体技术已趋成熟。脂质体药物产品及研究进展情况见下表。

脂质体药物的临床应用主要体现在其作为先进递药技术的优点上 :
▼增强了药物的溶解性
▼ 减低了药物毒性
▼ 赋予药物靶向性
▼ 增加了药物的缓释作用
▼ 提高了对药物的保护作用
▼ 通过融合作用将药物送人细胞浆或细胞核中
作为某个特定的脂质体药物制剂, 并非需要拥有上述所有优点, 而是应用了其某些特性, 从而使它发挥更好的治疗效果。就目前所研发的药物而言, 考虑到磷脂的价格和制备成本, 近期已经上市的脂质体药物多数集中在毒性较大的抗癌和抗感染物领域。
脂质体抗肿瘤药物
几乎所有的化疗药物都有很强的毒副作用。脂质体药物剂型可以在某种程度上提高化疗和抗感染药物的靶向性, 并大幅度地降低药物的毒副作用, 从而提高治疗指数。脂质体包裹的阿霉素可明显地降低心脏毒性和皮肤毒性, 试验动物的存活率比游离药物对照组高。虽然多种脂质体阿霉素配方见诸于文献, 包括聚乙二醇修饰的长循环脂质体, 以卵磷脂/胆固醇制备的常规脂质体 ” , 含有棕桐酸葡萄糖酯/二棕桐酸卵磷脂/胆固醇的脂质体 , 氟化卵磷脂为包材的稳定脂质体等, 目前, 只有聚乙二醇修饰的长循环脂质体阿霉素(商品名Doxil)被美国食品和药品管理(FDA)批准在欧美和日本上市用于治疗与艾滋病相关的Kaposi肉瘤, 常规脂质体阿霉素(商品名Myocet)也于2002年在欧洲被批准作为一线用药上市销售。Mayer等发现用鞘磷脂和胆固醇为包材制备的脂质体不需要聚乙二醇修饰就可以获得可观的长循环效果, 而且在放置时避免了药物的泄露。鞘磷脂脂质体包埋的长春新碱不仅降低了药物的毒性, 还明显提高了药效, 这是脂质体制剂中不多见的好结果。鞘磷脂脂质体长春新碱已完成了临床Ⅱ/Ⅲ期实验, 正等待FDA批准上市。其他配方的脂质体长春新碱制剂如聚乙二醇修饰的长循环脂质体也已进入临床。几乎所有报道的数据都证明, 通过脂质体包裹后抗癌药物的毒性显著降低, 药物在体内的分布得以改变, 药物的被动靶向增强。比如正电荷脂质体紫杉醇可以缩小肿瘤体积并延长小鼠存活率。张志荣等人用硫酸铵梯度法成功地制备了米托蒽醌长循环脂质体。无论是脂质体粒径和药物包封率都比较理想。Zou等发现不同结构的蒽环类抗癌药annamycin的脂质体制剂的药效较脂质体阿霉素更强, 并且克服了细胞的抗药性。他们使用的配方含有表面活性剂吐温(Tween 80), 可制成冻干粉针, 便于制剂的保存和运输。吐温有一定的副作用, 我国药品监督管理局(SDA)对静脉注射制剂中的吐温已有限量。所以该配方的毒性有待进一步研究。
脂质体抗菌抗感染药物
脂质体制剂用于抗菌药物有许多优点:可以降低毒性, 改变药代和药物的体内分布,增加血药浓度, 并提供缓释。脂质体可以靶向进入网状细胞, 而这也正好是细菌富集和存活的部位。更重要的是脂质体制剂可以改变药物的原有物理化学性质, 从而降低了细菌对药物的抗药性。
在抗菌/抗感染药物中, 脂质体两性霉素是研究的较多并最先上市销售的脂质体抗菌药物制剂。脂质体两性霉素的毒性显著降低, 但仍然保持了同等水平的药效。脂质体制剂降低毒性的机制可能是改变了药代动力学和增加了与高密度脂蛋白的结合。市面上销售的脂质两性霉素制剂有三种, 从严格意义上来说, 只有AmBISOme是真正的脂质体结构。虽然脂质体两性霉素多用于静脉注射, 动物实验证明呼吸道喷雾给药也能有效地治疗全身深度真菌感染。由于人的肺粘膜90%的组分是磷脂DPPC, 脂质体肺部喷雾给药不但能使药物直接送达病变部位, 提高药效, 还能起到保护肺粘膜的作用。
MiKasome,氨基糖苷类抗生素阿米卡星(硫酸丁胺卡那霉素)的脂质体制剂, 目前正在欧洲和美国进行二期临床试验。动物实验显示, 相对没有包埋的阿米卡星,脂质体制剂的毒性可降低50%。 减少了常规阿米卡星的耳毒性和肾毒性。脂质体具靶向性, 能提高药物在病灶部位的浓度, 从而增强疗效, 缩短疗程 ;脂质体包封的阿米卡星在血液循环中保留的时间比游离药物长, 从而延长药物在体内的存留时 间, 在细胞的生命周期中更好地发挥作用;另外, 脂质体将阿米卡星带入细胞内, 杀死耐药的结核杆菌, 具有很高的临床应用价值。流动性脂质体以低相变温度磷脂为包材, 可以和细菌的细胞膜融合从而把抗生素有效地送入细菌体内发挥作用。流动性脂质体对细菌有一定的靶向选择性, 降低了细菌的抗药性, 提高了受体药物敏感性 。
许多抗生素比如庆大霉素、土霉素 、环丙沙星和其他抗菌素药物一都可以开发成脂质体制剂。特别值得指出的是脂质体环丙沙星可以用分散法或pH梯度法包埋而制成脂质体制剂。pH梯度法的包封率可达90%, 体外和动物实验都证明制成的脂质体环丙沙星具有很好的药效。
脂质体多肽药物
活性多肽是易于氧化、水解的不稳定生物活性物质, 在体内易降解、半衰期短及生物利用度低, 影响药效的发挥。利用脂质体技术将多肽药物包裹在脂质体小球中, 减少了多肽的水解和酶解, 可以提高药物的治疗指数。某些多肽含有赖氨酸等碱性 氨基酸, 当笔者将多肽C端酯化或酰胺化后就可以用pH梯度法将其包裹在脂质体中。 但是, 就多肽和蛋白药物整体而言, 药物的包埋和制备难度较大。与传统小分子化学合成药物的脂质体制剂相比, 多肽和蛋白的分子量大包封率较低, 且易从脂质体中渗漏。多肽和蛋白是活性物质, 其立体结构非常重要, 所以对其立体结构影 响较大的脂质体制备方法就不适用。 因此提高包封率和制剂稳定性是脂质体多肽 和蛋白制剂研究中亟待解决的问题。
实验证明白介素-2可以被包裹在多囊脂质体或长循环脂质体中。脂质体白介素-2作为治疗肾炎的药物己进入临床Ⅱ实验。
仅限于皮下或肌肉注射用的多囊脂质体被称为DeepFoam。 这种脂质体多囊颗粒比细胞略大, 一 般为5-50μm, 可以在注射部位形成一个储存库, 药物随着脂质体的破裂和磷脂的水解而释放。此种多囊体脂质体既可避免药物在体内释放时形 成溃口, 又能达到缓释的作用。可以通过调节磷脂的配方和 药物与磷脂的比例来控制释放时间的变化, 药物的释放时间可以从1d到几个星期。此项技术已经用于 缓释的产品如白介素-2、类胰岛素生长因子-1、胰岛素、集落刺激因子、α-干扰素及其他肽类药物。
长循环包裹的细胞因子可以开发为疫苗的免疫佐剂。脂质体白介素-2不但可以增加血液和脾脏中的白细胞数, 还可诱发脾脏淋巴因子的激活以攻击癌细胞。用脂质体IL-7与脂质体膜蛋白env-2-3SF2协同免疫小鼠可显著增加免疫应答。产生的抗体也较之其他疫苗佐剂多。血红蛋白被包裹在脂质体中作为人造血浆, 其在体内的匹配性、毒性及血液中的半衰期都好于游离的血红蛋白。
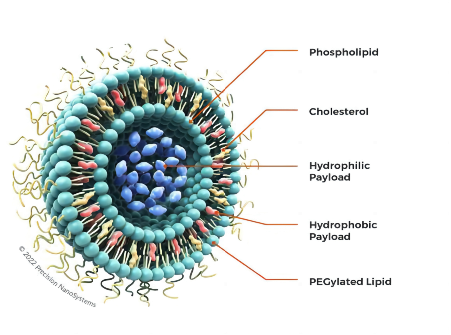
脂质体作为基因药物载体
随着人类基因组密码的解密成功, 在不远的将来, 通过基因修补和基因阻断来治疗各种疾病将不再是幻想。所谓基因修补药物是指通过引入DNA 来修补病变细胞的基因缺陷和错误,而基因阻断药物是用人工设计的反义核糖核酸片段与mRNA结合来阻断致病蛋白的合成。无论DNA还是RNA, 都是多元负电荷大分子活性物质,需要进入细胞浆或细胞核方能实现基因转染或基因表达, 从而发生药效。传统技术不能有效地保护核糖核酸以防止酶的水解, 更不能使药物穿透细胞膜, 不能解决基因药物的递药问题。 脂质体因其与细胞膜相似的化学结构, 有可能成为理想的基因载体。与病毒基因药物载体相比, 脂质体的优点是无毒, 无免疫原性, 易于工业化生产。许多制剂已经进入临床实验。关于脂质体作为基因药物载体已有许多综述, 笔者在此仅仅讨论制剂方面的问题和进展。
文献报道的用于基因转染的多数脂质体是正电荷脂质体。其主要组分为不饱和脑磷脂(DOPE)和正电荷化合物, 以50:50摩尔比制备而成。正电荷脂质体与DNA或RNA形成紧密团聚在一起的络合物, 通过吞噬机制进入细胞。当正电荷与细胞膜磷脂交换后, 脂质体与细胞膜融合, 从而失去了对DNA的络合作用, 将DNA或RNA释放入胞浆,完成基因阻断或基因复制。虽然关于络合物的制备、应用及分析文章非常之多, 但其结构仍然不是完全清楚。由于正电荷在DNA的络合、细胞 融合及基因表达等各个过程都起着主要作用,所以不同的正电荷化合物的结构、合成、毒性及基因转染表达效果是脂质体基因药物研究的重点。
运用表面活性剂分散-透析法, 加拿大不列颠哥伦比亚大学脂质体研究所的科学家们制成了真正脂质体包裹的DNA脂质体。这种被称为“稳定的质粒-磷脂微粒”的制剂由融合性不饱和脑磷脂, 少量正电荷磷脂和聚乙二醇-磷脂化合物组成。与正电荷脂质体-DNA络合物不同, 稳定的质粒-磷脂微粒非常稳定, 在血液中有较长半衰期。
Chen等设计了一 系列新的正电荷-聚乙二醇-磷脂化合物, 加入了这种新化合物的稳定的质粒-磷脂微粒有更强的细胞亲和性并能显著提高DNA的表达。近年来, 为了既提高脂质体基因药物的稳定性和在血液中的半衰期, 同时增加DNA的转染表达效率, 各种制备脂质体包裹的正电荷-DNA络合颗粒的方法也有较多的报道 。这种脂质体基因载体的设计构思来自于对膜病毒的仿生学, 有文献将其称之为人造病毒基因载体。由于外膜可以由不同磷脂构成、可以引入融合因子、用做高分子修饰及赋予靶向配体, 从而使得这种载体非常具有开发价值。
结语
脂质体技术的开发研究在国内也已有多年的历史。顾学裘、陈涛等许多专家都对脂质体制剂进行了深入的研究, 为我国的脂质体制剂发展作出了贡献。相信随着科研人员的持续创新和不懈努力,脂质体剂型必将逐步攻克技术瓶颈,在肿瘤靶向治疗、基因递送、疫苗开发等药物递送领域实现更多突破性应用。
未来,该技术将提升药物疗效、降低毒副作用、改善患者生活质量。让我们期待,脂质体技术不久将绽放光彩,为全球医疗健康事业注入活力,给患者带来治愈希望。


我要评论