脂肪乳专题(三)
脂质体微粒从其被发现之日起一直被看作是一种理想的递药技术, 其主要原因在于,虽然脂质体技术研究面对着临床精确给药这些问题的挑战, 但是多种不同特性的脂质体不断出现, 从而保证了脂质体技术不断的进步。目前已有数种脂质体药物制剂产品已经上市销售, 多种脂质体技术及制剂也广泛用于临床前和临床试验。大量验的实验数据显示脂质体可以选择性地富集在肿瘤发生、感染及发炎部位, 因而具有被动靶向性。
脂质体研究的各个方面, 包括磷脂制备、药物包裹、粒径控制、磷脂及脂质体药物稳定性的提高等方面都取得了长足的进步。特别是采用抗体或其他配体修饰脂质体, 将药物靶向病灶,以及通过聚乙二醇修饰脂质体表面, 提高脂质体在血液中的保留时间, 增加脂质体药物的生物利用度。但是, 许多常规脂质体仍然不能响应细胞水平的微环境变化, 不能在细胞内释放被包裹的药物, 因此不能充分发挥药效,其原因是:常规脂质体制剂被细胞摄取后, 在很多情况下都完好地逗留在细胞内的微器官中, 不能释放所包裹的药物或脂质体药物被溶酶体分解后排出了细胞外。
近年来, “ 智能型脂质体” 的构建是人们关注的热点之一。所谓“ 智能型脂质体” 是指这种脂质体在正常的体内环境中稳定, 当遇到特定的生理微环境(如酸度、温度 及离子强度等)变化时, 脂质体便会破裂或融合而释放其包裹的药物。有资料指出,在病灶处的某些理化参数往往不同于正常情况。像肿瘤和感染部位的较低, 发 炎处的温度较高。“智能型脂质体” 选择性地在这些部位破裂或融合, 就可以定位释放药物, 起到只杀伤病变细胞而不伤害正常细胞的理想选择。一般来说, 脂质体到达病灶后是以吞噬机制进人细胞内, 细胞通常会将含有脂质体的吞噬体选择性地送入溶酶体分解消除。正常的血液酸度为pH7.4左右, 而溶酶体内的酸度为PH4.0。
从吞噬体进入溶酶体的过程, 吞噬体本身的内部酸度需要从pH7.4逐渐降低到pH4.0。这一可观的酸度变化, 为酸敏脂质体的设计提供了实现的可能和构建的基础。总之, “ 酸敏智能型脂质体” 不仅利用了病灶处酸度的变化, 还可以巧妙地将脂质体的被动靶向性和细胞内的酸度变化结合在一起, 实现定向、定位、定点给药。本文试图对酸敏脂质体的国内外研发进展做些初步探讨。
酸敏性化合物与脑磷脂组成的酸敏脂质体
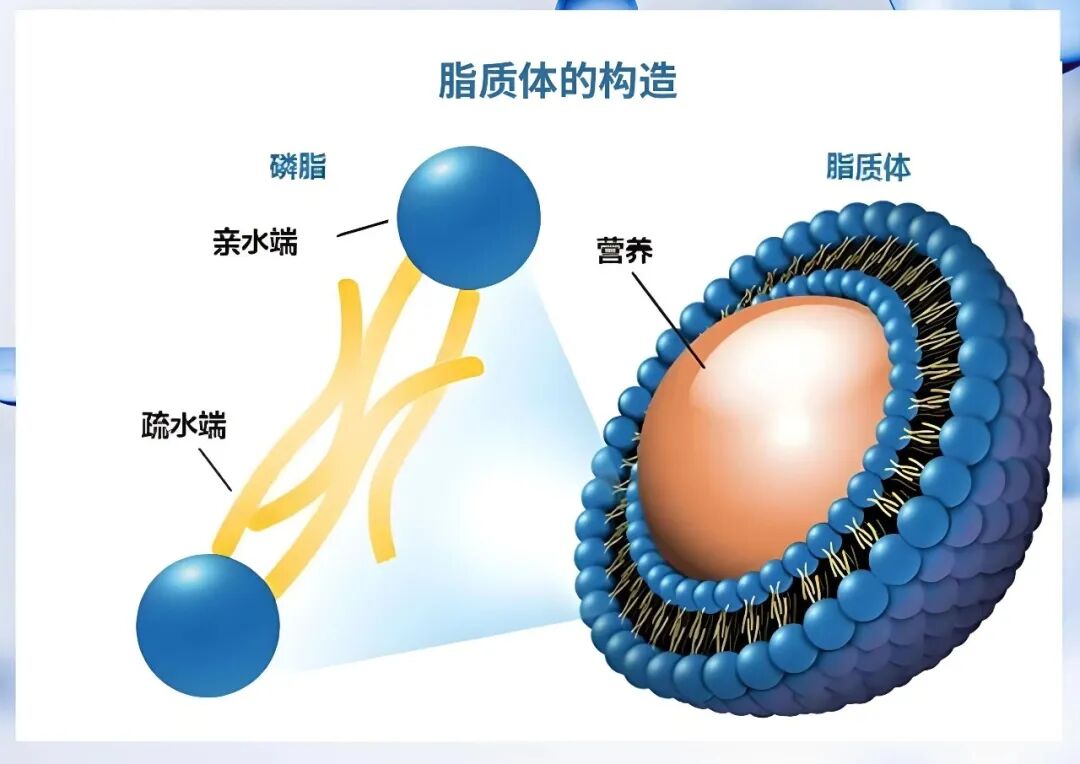
早期酸敏脂质体研究多数集中在选择不同的磷脂包材配方来实现脂质体的酸敏性。这类酸敏脂质体的最基本组分是不饱和脑磷脂(PE,unsaturated phos-phatidylethanolamine)和酸敏性化合物。文献报道说, 不饱和脑磷脂的立体形状呈圆锥体, 其头小身子大, 即亲水端小而亲油端大。不饱和脑磷脂单独不能形成脂质体双层膜结构。但是, 如果将不饱和脑磷脂的含量控制在一定的比例之内, 它也可以与其他易形成双层膜的磷脂或脂质化合物一同构成脂质体结构。如果所选择的其他磷脂或化合物恰好有酸敏性, 那么就可以获得酸敏脂质体。
酸敏脂质化合物的亲水部分含有酸敏性基团(多数为羧基)。在中性条件时, 羧酸基离子化, 其立体形状呈倒置圆锥体, 也就是头大身子小, 即亲水端大而亲油端小 ,这样就弥补了不饱和脑磷脂的立体缺陷,共同形成稳定的脂质体双层膜。酸性条件下, 羧酸基质子化, 亲水端立体体积相对变小了, 也就失去了对不饱和脑磷脂的补缺作用, 因而失去了对脂质体的稳定性。不稳定的磷脂膜驱使脂质体通过其本身或与相邻脂质体的互动从而形成新的稳定结构。这种结构的变化最终体现为脂质体的破裂或与其他脂质体的融合。细胞膜的基本构成也是磷脂双层膜结构, 酸敏脂质体在酸性条件下也能与之相互融合。所以酸敏脂质体可以通过融合作用成功地将药物送入细胞浆内, 达到细胞靶向给药。
油酸(OA,oleic acid)因其广泛存在于自然界、低熔点以及与脑磷脂的不饱和羧酸长链的良好相溶性而被广泛用来与不饱和脑磷脂相匹配, 用于制备酸敏脂质体。在中性条件下, 油酸和脑磷脂以小于30%摩尔比混合, 可以形成稳定的脂质体。当溶液pH小6.5时, 油酸质子化破坏了脂质体的稳定性, 其内容物从脂质体中泄露出来并相互融合。仅含油酸 (油酸/卵磷脂体系)或仅含脑磷脂(phorsphatudylserin)的对照组脂质体在非常低的酸度pH4.0仍然没有观察到脂质体聚合和融合现象发生。实验结果提示油酸和脑磷脂两者都是该类型酸敏脂质体所必备的主要物质。在脑磷脂和油酸的脂质体体系中加入胆固醇(Chol,Cholesterol)可以增加其在血清中的稳定性 , 所以OA/PE/Chol三组分酸敏脂质体被用来研究外源DNA的细胞内表达和反义核糖核酸的导入。与常规脂质体相比较,这种三组分酸敏脂质体可以明显提高基因表达和基因阻断效果。除了油酸外,也有用其他脂肪酸与脑磷脂一起制备酸敏脂质体的报道。
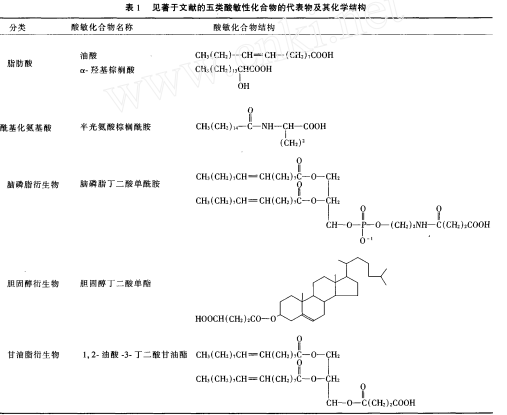
脂肪酸修饰氨基酸生成的氨基酸脂肪酞胺(如半胱氨酸单棕搁酰胺, palmitoylhomocysteine)与不饱和脑磷脂也可以形成稳定的酸敏脂质体。酸性磷脂、脑磷脂的二元酸化衍生物、胆固醇的丁二酸衍生物以及其他酸敏性化合物都可以与不饱和脑磷脂生成酸敏脂质体。酸敏性化合物可以细分成五类, 其代表化合物以及其化学结构见表1。
酸敏性化合物与脑磷脂组成的脂质体实现了人们对酸敏智能型脂质体的初步设想。由于这种脂质体都需要高含量的不饱和脑磷脂来增强其不稳定性, 帮助酸敏性化合物在酸性条件下对脂质体的破坏。所以这类脂质体存在着先天缺陷, 使得酸敏性磷脂组成的脂质体在正常情况下的稳定性不易解决。
酸敏性蛋白和多肽修饰的脂质体
病毒的融合蛋白, 比如血凝素(HA,hemagglutinin), 是病毒进人并与细胞融合的关键因子。在酸性环境中, 病毒蛋白发生结构变化, 诱导催化病毒外壳和细胞膜间的融合, 帮助病毒DNA进入细胞内, 引起病变。基于对病毒蛋白的结构解析、对其融合机理的研究以及酸敏性的了解, Stegamnn和Bron分别将血凝素与磷脂进行了重组, 制备了酸敏脂质体。他们将这种蛋白酸敏脂质体称之为“人工病毒体”(virosmes)。“ 人工病毒体”不仅可以与脂质体融合, 也可以与细胞膜、质粒膜及吞噬体膜融合, 并已经用在了体外基因转染研究中。
借助于疏水性、螺旋性以及膜间的相互作用的逻辑分析, 人们合成筛选了一批在酸性条件有融合性的多肽。比如Szoka设计并合成了30个氨基酸的多肽(GALA)。该人工全合成多肽在正常生理pH下溶于水, 同时可以镶嵌在磷脂双层膜中。更为重要的是GALA肽链能从pH7.5的无规卷曲状态变为酸性条件的两性α-螺旋体。酸敏性多肽的人工合成拓宽了酸敏脂质体的设计角度和制备方法。酸敏多肽修饰的脂质体保留了蛋白的酸敏融合特性, 有利于生产工艺的优化。但是,无论是酸敏蛋白还是酸敏性多肽都仍有免疫活性。有文献报道, 当抗原与脂质体共用时, 脂质体显示出很强的免疫佐剂特性, 能强化抗体的产生和记忆力。所以, 酸敏蛋白或多肽与脂质体表面连接后, 如何去掉或减轻免疫原性, 成为今后研究必须面对的重要问题。
酸敏性高分子材料修饰的脂质体
酸敏性高分子是近来酸敏脂质体研究工作中的重点之一。与前面提及的酸敏脂质体的不同处是构建这类脂质体的磷脂不需要限制为脑磷脂。由于酸敏高分子脂质体的酸敏作用和融合性非常高, 它们可以破坏多种脂质体, 包括由卵磷脂/胆固醇形成的最稳定的脂质体双层膜, 并使其相互融合。高分子可以通过不同的方法镶 嵌在脂质体双层膜内或选择性地修饰脂质体外表面。酸敏高分子可以分为两类:含氨基的高分子和含羧酸基的高分子。含氨基的高分子, 如蜂毒素、多粘菌素B、聚赖氨酸、聚组氨酸及其他高分子正电荷材料在酸性条件下质子化成为多电荷聚合物, 这些高分子能有效地进入细胞, 并已证明在吞噬体的酸性环境下能与吞噬体膜融合。高分子氨基材料制备的脂质体的融合对象仅仅局限于负电荷脂质体。含有多个羧酸基分子化合物也可用来构建酸敏脂质体。聚乙二醇是人们熟知的促细胞融合剂。通过化学修饰在聚乙二醇高分子中引入羧酸基侧链和亲油基团后,就可以制备成酸敏高分子脂质体。实验证实这种设计和制备的脂质体具有酸敏融合性能。
Tirrell报道聚2- 乙基丙烯酸高聚物(PEAA)在中性水溶液中呈伸展的亲水卷曲状;在酸性水溶液中分子构象变为紧缩的球状体。PEAA在酸性条件下, 可以破坏脂质体的稳定性并引发脂质体的融合。用PEAA修饰的卵磷脂小单室脂质体(SUVs,small unilamellar vesicles) 或卵磷脂/胆固醇大单室脂质体(LUVs,large unilamellar vesicles)都呈现出优良的酸敏脂质体应该具有的综合性质, 即在正常酸性pH5.0左右水溶液中稳定, 在低pH时释放脂质体内容物并产生融合。在模拟细胞吞噬体的酸性环境pH5.0左右的实验中, 以荧光染料钙黄绿素(calcein)为模型物,PEAA修饰的卵磷脂/胆固醇大单室脂质体几乎定量释放出了其内容物, 可以达到80%-90%的脂质体融合并观察到脂质体粒径的明显增大(从原先的100nm变为融合后的400nm以上)。酸敏PEAA脂质体不仅能很好地与其他脂质体融合, 同时也能与红血细胞融合。化学合成的聚2- 乙基丙烯酸脂肪酰氨含有亲油基团, 可以在制备脂质体时定量地按一定比例和其他磷脂混合使用, 使得聚2-乙基丙烯酸通过脂肪酸链与磷脂长链的亲合作用, 稳定地固定在脂质体膜内外表面, 从而简化了PEAA脂质体的制备工艺。为了节省脂质体的内容体积, 也可以用镶嵌的方法将聚2-乙基丙烯酸脂肪酰胺嵌入预先制成的包埋了药物的脂质体外膜中。实验证明嵌入法为高分子酸敏脂质体的制备的又一新方法。
酸敏脂质体是新一代智能型脂质体。它的设计巧妙地利用了正常人体生理条件与病变部位酸性的差异, 以及细胞内外微器官的酸性差异, 控制脂质体有选择地在病 灶处的细胞内破裂或与细胞吞噬体膜融合, 达到定位、定点药物释放。酸敏脂质体无疑是先进脂质体药物制剂研究领域中非常重要的分支。随着生物技术的进步,基因药物的探索和开发将会成为今后药物研究的前沿和重点。由于基因药物在血液中不稳定, 必需完整无损地将DNA送入细胞核或将RNA送入细胞浆中才能产生药效。传统的给药技术显然不能满足基因药物制剂的需要。本文论述的酸敏脂质体为基因新制剂的研究提供了新的手段和途径。虽然现阶段正在研究的酸敏脂质体仍然有许多问题有待解决, 离实际应用还有一段距离,但是, 酸敏脂质体的研究代表着脂质体药物制剂的方向, 值得国内同行加以重视和努力。


我要评论